 |
 Как обустроить мансарду?  Как создать искусственный водоем?  Как наладить теплоизоляцию?  Как сделать стяжку пола?  Как выбрать теплый пол?  Зачем нужны фасадные системы?  Что может получиться из балкона? |
Главная страница » Энциклопедия строителя
содержание:
[стр.Введение] [стр.1] [стр.2]
страница - 0
Изучение комплексообразования ионов железа (II) с кислородом и 2,6- дигидрокситолуолом в водных растворах методом переменнотоковой вольтамперометрии
А.А. Ревина(1), П.М. Зайцев(2), Л.Р. Шарифуллина(З) (lili@quake.ru),
Н.В. Брянцева (3)
1.- Институт электрохимии им. А.Н. Фрумкина РАН, 2.- Научно-исследовательский институт по удобрениям и инсектофунгицидам им. Я.В. Самойлова, 3. - Российский Химико-Технологический Университет им. Д.И. Менделеева
Железо и кислород являются наиболее распространенными элементами в земной коре и природных ресурсах и входят в состав жизненно важных соединений, участвуют в различных биологических процессах организмов животных, человека и растений, а также в химических производствах и биотехнологиях [1,2]. В связи с возрастающим выпуском огромного набора фармацевтических препаратов и пищевых добавок, содержащих в качестве микроэлементов Fe, становится острым вопрос о выяснении механизма его взаимодействия с биоорганическими соединениями, антиоксидантами, которые ответственны за направление функциональной активности препаратов. К таким соединениям относятся фенольные и полифенольные соединения. В растительном мире фенольные соединения представляют одну из важнейших групп биологических веществ [3]. Они участвуют в дыхании, фотосинтезе, широко применяются в пищевой промышленности благодаря их окислительным превращениям, в частности, в производствах чая, кофе, вина, а также в качестве пищевых красителей и антиоксидантов [3]. Поэтому сведения о характере взаимодействия железа (II) c молекулярным кислородом (в дальнейшем кислород) и 2,6-дигидрокситолуолом (в дальнейшем С7) в водных и водно-органических растворах представляют интерес для широкого круга специалистов.
Настоящее исследование посвящено изучению комплексообразования О2 с ионами Fe2+ и С7 в водных растворах методом переменнотоковой вольтамперометрии [4]. Этот метод характеризуется тем, что высоты переменнотоковых пиков восстановления деполяризаторов с участием одного и того же количества электронов могут уменьшаться в 10 и более раз при переходе от обратимого электродного процесса к необратимому [4]. Метод имеет и более высокое разрешение (15-20мВ) по сравнению с постояннотоковой полярографией [5]. Обычно комплексообразование приводит к изменению обратимости электродного процесса и потенциала восстановления, что позволяет проследить по изменению высот переменнотоковых пиков восстановления присутствующих в растворе соединений и их потенциалов за появлением новых пиков реагирующих веществ. С использованием этого метода было изучено комплексообразование Cu2+ c оксикарбоновыми и аминокислотами [6,7];
2+
Zn c молекулярным кислородом и дипептидом [8,9].
Экспериментальная часть. В настоящей работе использовался вольтамперометрический анализатор «АВС - 1.1» фирмы «Вольта» (РФ) в переменнотоковом трехэлектродном режиме в комплекте с компьютером, со стационарным ртутным электродом в виде висящей капли. Электродом сравнения был насыщенный хлорсеребрянный электрод, соединенный с полярографируемым раствором через мостик, заполненных 0,1М NaClO4, а вспомогательным - платиновая проволока. Каждую переменнотоковую вольтамперограмму регистрировали только на одной капле в герметичной полярографической ячейке при следующих параметрах: частота прямоугольной модуляции 25 Гц, амплитуда модуляции 30 мВ. Применяемые в работе реактивы FeSO4, NaClO4 имели квалификацию х.ч., 2,6-дигидрокситолуол (5-methylresorcinol) фирмы «Sigma» трижды перекристаллизовывали. Растворы готовили на бидистиллированной воде. Исследования проводились в растворе 0,1 М NaClO4 c рН = 5,6-6,6 при 20оС. Удаление
кислорода из растворов осуществлялось барботированием чистым аргоном в течение 10-15 мин. Концентрацию кислорода в растворе определяли по методу Винклера [9]. В изученных растворах, насыщенных кислородом воздуха, она была постоянной и равной 3*10-4 моль/дм3.
Исследование комплексообразования между Fe2+, O2 и С7 проводили в растворах, содержащих О2 и С7 при [O2] = const =3*10-4 моль/дм3; Fe2+ и C7 при [Fe2+]= const = 2*10-4
32+2+-43-43
моль/дм ; Fe - O2 - C7 при [Fe ]= 1*10 моль/дм и [O2] = 3*10 моль/дм , и дополнительно в растворах Fe2+,C7 в отсутствие кислорода воздуха. В полярографическую ячейку, содержащую 40 см3 раствора с постоянной концентрацией О2 и Fe2+, вносили определенный объем раствора [С7]= 1*10-2 моль/дм3, перемешивали струей воздуха, а в растворе Fe2+ - C7 - струей аргона до исчезновения на полярограмме пика восстановления О2. После этого создавали на электроде ртутную каплю размером »700мкм и проводили измерение тока.
Результаты и их обсуждение.
2+
В изученных растворах ионы Fe и О2 электрохимически активны в диапазоне от 200 до -1800мВ, а С7 - неактивен в области от +200 до -1800мВ [5]. В режиме постояннотоковой полярографии О2 восстанавливается в две двухэлектронные ступени. В нейтральной среде по первой ступени восстановления образуется НО2- а по второй НО2- переходит в НО- (Е1/2 = -1040 мВ) [5]. Ионы Fe2+ в растворе 1М NaClO4 восстанавливаются в одну двухэлектронную ступень с Е1/2 = -1430 мВ [5].
В работе [10] представлены результаты исследования электронного восстановления Fe2+ в присутствии и отсутствие O2 в водных растворах. Показано, что образуются комплексные соединения различного состава nFe2+*mO2, в данной работе был выбран раствор с комплексом [Fe2+*3O2] На представленных вольтамперограммах растворов (рис.1) при избытке Fe2+ по отношению к концентрации растворенного молекулярного кислорода наблюдаются пики восстановления О2 в области потенциалов от +50 до -100мВ (Еп = -35 мВ) и пик восстановления Fe2+ при значении Е1/2 = -1400 мВ.
РИС.1.Переменнотоковые
вольтамперограммы растворов Fe2+ и
О2 (избыток Fe2+) на фоне 0,1М
NaClO4 с рН=5,6 при различном их
соотношении. Концентрации FeSO4 и
О2, моль/дм3, С*104: 0 и 3,00 (1); 2,38
и 0 (2); 2,33 и 0,074 (3); 2,13 и 0,34 (4);
2,00 и 0,51 (5); 1,94 и 0,61 (6); 1,75 и
0,84 (7); 1,61 и 1,03 (8).
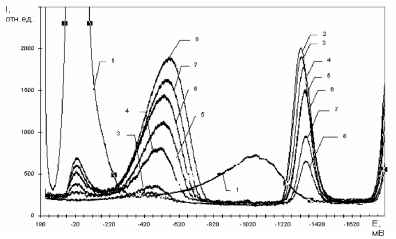
Кроме того наблюдается новый пик восстановления НО2- в области потенциалов от -300 до -800 мВ, высота которого с ростом концентрации О2 в растворе смещается в катодную область (рис.1 кривые 2-8). Пик электрохимического восстановления О2 по второй ступени с Еп= -1040мВ (рис.1, кривая 1) в присутствии избытка Fe2+ на вольтамперограмме не наблюдается.
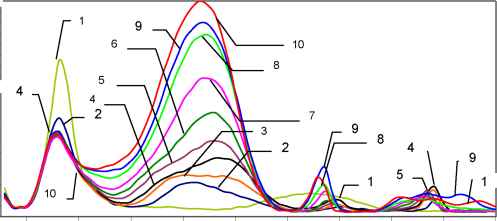
На вольтамперограмме растворов (рис.2) в избытке О2 с увеличением [Fe2+] кроме
2+-
указанных пиков восстановления О2, Fe и каталитического восстановления НО2 , появляется пик внутрикомплексного восстановления надперекисного иона О2- в области потенциалов с Еп02- от -1014 до -1093 мВ, высота и значение Еп которого зависят от концентрации Fe2+ в растворе (рис.2).
х
о
10000 -,
-- 8000
6000 А
4000 2000
0
100 -100 -300 -500 -700 -900 -1100 -1300 -1500 -1700
E, мВ
РИС.2
Переменнотоковые вольтамперограммы растворов Fe2+ и О2 (избыток О2) на фоне 0,1М NaClO4 срН=5,6, [O2] = const = 3*104моль/дм3. КонцентрацияFeSO4, моль/дм3, С*104: 0 (1); 0,49 (2); 0,95 (3); 1,40 (4); 1,82 (5); 2,22 (6); 2,61 (7); 2,98 (8); 3,33 (9); 3,67 (10).
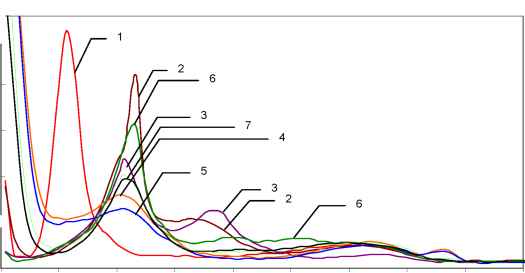
При добавлении в аэрированные растворы С7 пики восстановления О2 резко
изменяются (рис3 кр1-7). I, отн.ед.
10000 L
8000
6000
4000
2000 V
200
-200
-400
-600
-800 -1000 -1200 -1400 -1600
РИС.3
E, мВ
Переменнотоковые вольтамперограммы растворов С7 и О2 на фоне 0,1М NaClO4 с рН=5,6-6,6; [O2] = const = 3*104моль/дм3 (1). Концентрация С7моль/дм3, [С7]*104: 0,00 (1); 1,5 (2); 3,03 (3); 5,78 (4); 8,00 (5); 11,12 (6); 14,89 (7).
0
0
содержание:
[стр.Введение] [стр.1] [стр.2]