 |
 Как обустроить мансарду?  Как создать искусственный водоем?  Как наладить теплоизоляцию?  Как сделать стяжку пола?  Как выбрать теплый пол?  Зачем нужны фасадные системы?  Что может получиться из балкона? |
Главная страница » Энциклопедия строителя
содержание:
[стр.Введение] [стр.1] [стр.2]
страница - 1
При сохранности пика восстановления О2 по второй ступени (Еп =-1040мВ) наблюдаются три новых пика восстановления с величинами потенциала Еп для первого нового пика от -113 до -155 мВ, для второго от -240 до -282мВ, для третьего от --558 до -632 мВ. Наблюдаемую картину можно объяснить восстановлением комплексов, образующихся при взаимодействии О2 с С7:
nC7 + O2 о [nC7...O2]
Кривая зависимости высоты второго нового пика от величины мольного отношения n= [C7]/[O2] имеет сингулярные точки при n = 1, 2, 3 (рис.4), что говорит об образовании комплексных соединений стехиометрического состава [О2*С7], [О2*2С7], [О2*3С7].
от.ед. тока
7200
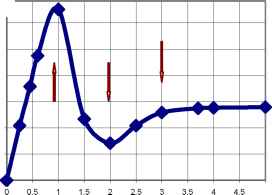
РИС.4
Зависимость от мольного отношения n = [C7]/[O2] высоты (Н) пика восстановления О2 при постоянном потенциале -270мВ на фоне 0,1МNaClO4 с рН=5,6-6,6; содержащем 3*104 моль/дм3 О2. Стрелками указаны вероятные составы образующихся комплексов.
5
[C7]/[O2]
На вольтамперограммах деаэрированных растворов Fe2+ - C7 наблюдалось увеличение
2+2+
ширины пика восстановления Fe с ростом содержания С7 до мольного отношения [C7]:[Fe ] = 1:1, а затем ширина пика остается неизменной. Это указывает на образование комплекса состава 1:1 ([Fe2+]:[C7]), что согласуется с известным фактом образования п-комплексных соединений ионов металлов с бензольным кольцом ароматических соединений [11].
6000
4800
0
I, отн.ед. 8000
6000
4000
2000
0
200 0 -200 -400 -600 -800 -1000 -1200 -1400 -1600 -1800
E, мВ
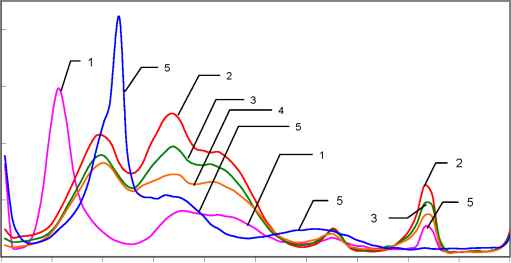
РИС.5. Переменнотоковые вольтамперограммы растворов FeS04022,6-
дигидрокситолуол (С7) на фоне 0,1МNaCl04 срН=5,6-6,6; содержащем 3*104 моль/дм3 О2. Концентрации FeS04 и С7, моль/дм3, С*104: 1,25 и 0 (1); 1,22 и 1,22 (2); 1,14 и 4,55 (3); 1,09 и 6,52 (4); 0 и 2,4 (5).
2+
На рис.5 представлены вольтамперограммы растворов Fe - O2 c мольным соотношением [Fe2+]:[O2] = 1:3 при добавлении C7.
Первый из наблюдаемых пиков соответствует восстановлению О2 по первой
02
двухэлектронной ступени с Еп = -25мВ, второй и третий размытые пики соответствуют
2+
восстановлению НО2" в комплексе [Fe .. .HO2"] и имеют соответственно различные величины Еп, равные -510 и -680мВ. Четвертый и пятый пики имеют величину Еп соответственно -1100 и -1470мВ и обусловлены восстановлением О2- и гидроксокомплексов Fe2+. Вольтамперограммы этих растворов в присутствии С7 характеризуются также наличием пяти пиков, высоты которых изменяются от содержания С7 в растворе (рис.5, кривые 2-4).
Первые три пика - это новые пики, потенциалы (En) которых существенно отличаются
2+
от таковых как для растворов Fe - O2, так и для растворов О2 - С7. Потенциал первого нового пика (En = -210мВ) имеет промежуточное значение между потенциалами первого (от -113 до -155 мВ) и второго (от-240 до -282мВ) пиков восстановления О2 в растворах О2 - С7. Потенциал второго (En = -475мВ) и третьего (En = -640мВ) новых пиков в растворах Fe2+ - O2 - C7 смещены в анодную область по сравнению с таковыми для пиков каталитического
2+
восстановления НО2" в растворах Fe - O2. Величины En четвертого и пятого пиков
2+2+
вольтамперограмм растворов Fe - O2 - C7 точно совпадают с таковыми для растворов Fe -O2 и соответствуют восстановлению O2- и комплексов Fe2+ (рис. 2, 5). Отметим, что с ростом концентрации С7 в растворах Fe2+ - O2 - C7 высоты пиков восстановления О2- (hnO2-), железа (hnFe2+) и каталитического восстановления НО2- (1икат) проходят через максимум. При этом отношение hnFe2+/hnO2- остается практически постоянным и равным 3 (рис5). Наблюдаемые
2+
изменения характеристик восстановления Fe и O2 в присутствии C7 указывает на их взаимодействие. Для определения возможного состава образующихся комплексов проанализированы зависимости hnFe2+ (рис.6, кривая 1) и 11кат от мольного отношения Z = [C7]/[Fe2+] (при [O2] = const = 3*10-4моль/дм3) при постоянных потенциалах -475 и -635 мВ
(рис.6, кривая2 и3), а также высоты пика восстановления О2 по первой ступени при -210мВ (рис.6, кривая2).
Н, отн.ед.
5000
4000
3000
2000
1000
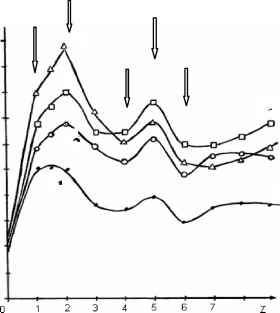
РИС.6. Зависимость от мольного отношения Z = [C7]/[Fe2+] высот (Н) переменнотоковыхпиков
восстановления Fe2+(1), О2 (3) с Еп = -210 мВ и каталитических пиков восстановления НО2 при постоянных потенциалах -475 (4) и -635 (2)мВ в растворах Fe2+ - O2 - C7 c постоянной концентрацией О2, равной 3*10 4моль/дм3. Стрелками указаны точки пересечения касательных к кривым.
Анализ указанных кривых на рис.6 показывает, что их точки экстремумов и пересечения касательных к ним соответствуют значениям Z = 1, 2, 4, 5, 6. что свидетельствует об образовании комплексных соединений nFe2+*3O2*mC7, где m = Z при n=1.
Таким образом, образующиеся разнолигандные комплексы в объеме раствора состава Fe2+* 3O2*mC7 (m=1, 2, 4, 5, 6,) подтверждается и поведением каталитического
-2+-
восстановления НО2 и Fe , отражающих реакции в приэлектродном слое уже с участием НО2 и OH-.
Известно, что при окислении Fe2+ в водных растворах кислородом имеет место равновесие [12]:
Fe2+ +O2 <-> [Fe2+...O2] ~ [Fe3+...O22~ ] Комплекс [Fe3+...O2~] принимает участие в дальнейших реакциях с образованием Fe3+ и Н202 [12].При избытке кислорода схема реакции восстановления имеет вид:
[Fe2+ ...nO2] о [Fe3+...(n-1)O2...OY](1)
В присутствии С7 реакции образования разнолигандных комплексов представляются схемами (2-3):
Fe2+ + nO2 + mC7 <-> [Fe2+ . n*O2 .. .m*C7](2)
[Fe3+...(n-1)O2...O-2 ] + mC7 <-> [Fe3+...(n-1)O2...O"2 ...111C7 ](3)
Ионы Fe3+ восстанавливаются в области потенциалов растворения ртути (+200мВ) [5]. Однако в комплексных соединениях с лигандами - анионами ионы Fe3+ восстанавливаются уже при отрицательных потенциалах [5]. Реакция протекает по схеме: [Fe3+...(n-1)O2...O"2...m C7] +е- <-> [Fe2+...(n-1)O2...O~2...mC7 ] Внутрикомплексное восстановление О2 в образующихся комплексных соединениях протекает согласно схемам реакций:
[Fe2+.. .nO-2.. .m C7] +2ne- + nH2O <-> [Fe2+.. .nHO-2.. .mC7] +nOH-
[Fe2+ ...(n-1)O2 .O2 ...111C7] + 2(n-1)е- + (п-1)Н2О <-> [Fe2+...(n-1)ro-2 ...O2 ...П1С7] + (n-1)OH-
3
1
содержание:
[стр.Введение] [стр.1] [стр.2]