 |
 Как обустроить мансарду?  Как создать искусственный водоем?  Как наладить теплоизоляцию?  Как сделать стяжку пола?  Как выбрать теплый пол?  Зачем нужны фасадные системы?  Что может получиться из балкона? |
Главная страница » Энциклопедия строителя
содержание:
[стр.Введение] [стр.1]
страница - 0
Фазовый переход в Fe(CnO2Hi9)3 вблизи 115 K
Наумов В.Н., Беспятов М.А. (bespytov@che.nsk.su ), Фролова Г.И.,
Стабников П.А., Игуменов И.К.
Институт неорганической химии им. А.В. Николаева Сибирского отделения Российской академии наук
АННОТАЦИЯ
Теплоемкость трис-дипивалоилметаната железа Fe(C11O2H19)3 измерена адиабатическим методом в интервале 57-316 K. Обнаружена аномалия в теплоемкости с максимумом при температуре ~ 115 K, которая указывает на фазовое превращение в комплексе. Выделены аномальные вклады в энтропию и энтальпию. Аномальная энтропия с точностью экспериментального определения равна Mn2, что типично для фазовых переходов типа порядок-беспорядок. Рассматривается возможная причина обнаруженного фазового перехода.
ВВЕДЕНИЕ
Дипивалоилметанат железа Fe(C11O2H19)3 или Fe(dpm)3 относится к классу комплексов переходных металлов с р-дикетонами. Эти соединения в твердом состоянии относятся к кристаллам молекулярного типа. Благодаря высокой летучести, р-дикетонаты используются в качестве прекурсоров в процессах химического осаждения покрытий из паровой фазы (MO CVD). Использование MO CVD является перспективным для получения сверхпроводящих материалов [1, 2], наноразмерных покрытий
[3] и др.
В настоящее время термодинамические и другие физико-химические свойства р-дикетонатов недостаточно изучены, хотя их знание необходимо для оптимизации MO CVD процессов, при расчете характеристик равновесия и стабильности системы кристалл-газ и т.д. Для надежного вычисления термодинамических функций - энтальпии, энтропии и других - необходимы экспериментальные данные о теплоемкости в области низких температур. Прогноз этих данных на основе различных исследований (эмпирические подходы, моделирование в рамках динамики решётки [4, 5] и т.д.) затруднителен в связи со сложностью структуры р-дикетонатов и возможными фазовыми превращениями в этих соединений при низких температурах [5-7].
В данной работе представлены результаты экспериментального исследования теплоемкости в области низких температур трис-
дипивалоилметаната железа Fe(C11O2H19)3, которые указывают на существование фазового перехода при 115.25 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Комплекс Fe(C11O2H19)3 синтезирован в водно-спиртовой среде при сливании стехиометрических количеств FeCl3-6H2O и лиганда НС1102Н19, нейтрализованного NaOH. Образующиеся кристаллы Fe(dpm)3 отфильтровывали и промывали дистиллированной водой, затем перекристаллизовывали в системе ацетон-вода. Окончательную очистку вещества проводили сублимацией в вакуумной градиентной печи при
2°
давлении 10 мм.рт.ст. с выделением зоны осаждения 120-^130 С.
Визуально образец Fe(dpm)3 при комнатной температуре представлял собой кристаллический порошок кирпично-красного цвета со средними размерами кристаллитов ~0.3 мм. Температура плавления Тм,
О
определенная на столике Боэтиуса, равна 164 С (437 K), что хорошо
О
согласуется с Тм =163 С (438 K), полученной в работе [8]. Спектры ИК и дериватограмма показывают соответствие полученного соединения трис-дипивалоилметанату железа. Согласно результатам рентгенофазового анализа, соединение однофазно и структура полученных кристаллов соответствует установленной в работе [9] структуре Fe(dpm)3 с параметрами решетки а = 20.325 ± 0.008 A, b = 17.350 ± 0.007 А, с = 23.171 ± 0.009 А, в = 111.98 ± 0.03 град.; пространственная группа С2/с; число молекул в элементарной ячейке Z=8 . Расчетная рентгенографическая плотность, по данным [9], равна 1.061 ± 0.001 г см , экспериментальная (пикнометрическая) плотность равна 1.060 ± 0.003 г см . По результатам элементного анализа процентное содержание углерода С в образце составляет 51.08 % (расчетное - 51.02 %); процентное содержание водорода Н - составляет 6.03 % (расчетное - 5.99 %), что в пределах экспериментальной точности соответствует стехиометрическому составу
Fe(C11O2H19)3.
Теплоемкость образца измерена адиабатическим методом в интервале температур 57-316 K на описанной в работах [7] установке. В калориметрическую ампулу было загружено 4.326 г вещества. Масса моля, вычисленная согласно формуле Fe(С11О2Н19)3, равна 605.659 г. В режиме ступенчатого нагрева было получено 75 экспериментальных точек теплоемкости. Методом непрерывного нагрева в окрестности фазового перехода (105 - 129 K) была снято 124 точки. Эти экспериментальные точки были вычислены на основе снятия термограммы (зависимость температуры калориметра от времени при нагреве с постоянной мощностью в адиабатических условиях).
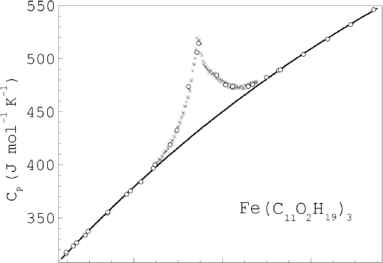
На экспериментальной зависимости теплоемкости от температуры Cp(T) наблюдается аномалия с острым максимумом при температуре ТС =
115.25 K (см. Рис. 1). Вид аномалии свидетельствует о фазовом превращении в соединении Fe(dpm)3.
100120140 Т(К)
Рис.1. Зависимость теплоёмкости от температуры СР(Т) для Fe(C11O2H19)3 в окрестности фазового перехода: кружки - теплоёмкость полученная методом ступенчатого нагрева; крестики - теплоёмкость полученная методом непрерывного нагрева; сплошная линия - регулярное поведение теплоёмкости.
Аномальная часть в максимуме (76.32 Дж моль-1К-1) составляет 17.5 % от регулярной теплоемкости Creg (Рис.1). Для выяснения природы аномалии была измерена статическая магнитная восприимчивость х изучаемого соединения на SOUID-магнитометре в интервале температур 2300 K. На Рис.2 она представлена в координатах 1/х(Т).
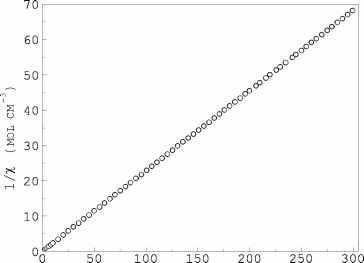
Т (К)
содержание:
[стр.Введение] [стр.1]