 |
 Как обустроить мансарду?  Как создать искусственный водоем?  Как наладить теплоизоляцию?  Как сделать стяжку пола?  Как выбрать теплый пол?  Зачем нужны фасадные системы?  Что может получиться из балкона? |
Главная страница » Энциклопедия строителя
содержание:
[стр.Введение] [стр.1] [стр.2] [стр.3]
страница - 1
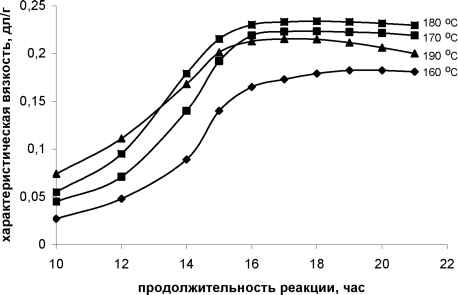
Рис. 1. Влияние продолжительности и температуры синтеза на характеристическую вязкость ПИД. На ММ ПИД значительное влияние оказывает концентрация исходных мономеров (см. рис. 2). Найдено, что повышение концентрации раствора до оптимальной (0,7-0,8 моль/л) способствует образованию высоковязкого полимера. Увеличение исходной концентрации мономеров выше оптимальной, создает трудность в диффузии участвующих в реакции молекул, что уменьшает вероятность столкновения функциональных групп и предопределяет снижение ММ полимеров.
о о
К СО
0,3 п 0,25 -
0,2 0,15
0,1 0,05 -\
0
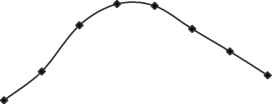
0,30,50,70,91,1
концентрация мономеров, моль/л
Рис. 2. Влияние концентрации мономеров на характеристическую вязкость ПИД. При известной способности N-метил пирролидона (МП) самостоятельно связывать выделяющейся при поликонденсации хлороводород дополнительно в качестве акцептора
Электронный журнал ИССЛЕДОВАНО В РОССИИ 9 1 2 http://zhurnal.ape.relarn.ru/articles/2005/086.pdf использовали как триэтиламин (ТЭА), так и пиридин результаты представлены в таблице 1.
Таблица 1.
Влияние концентрации акцептора хлороводорода на характеристическую вязкость ПИД
Акцептор | Количество | |
ТЭА | стехиометрическое | 0,26 |
ТЭА | 10 % избыток | 0,21 |
Пиридин | стехиометрическое | 0,20 |
0,13 |
Применение мольного недостатка ТЭА заведомо не оправдано, т.к. не связанный хлороводород будет блокировать БФ. Использование систем растворитель/акцептор приводит к дополнительному позитивному эффекту. Применение совместно с МП ТЭА очевидно предпочтительней, что согласуется с его более высокой константой основности -5,610-4, тогда как у пиридина - 2,010-9 [4]. Заметим, что МП, как и другие амидные растворители, не нивелирует силу основания. Более того, в растворителях этого типа основность третичных аминов обычно возрастает [5].
Дальнейшие исследования реакции ПК показали, что правило строгого эквимолярного соотношения мономеров в данном случае неприменимо. Так, наибольшая вязкость продукта наблюдается при избытке электрофила, равного 0,011-0,007 моль/л. Отчасти причиной является возможность побочного взаимодействия ИХ, с молекулами растворителя с образованием иминиевого комплекса (аддукта Вильсмайера) по
следующему механизму:
-C=N—R... +
1
CH3
с
Cl*
— C—N—R...
I Ъ
:O:
I
O_
Cl -ch3
Так и возможность гидролиза ИХ из-за присутствия "следовых" количеств влаги.
Сродство растворителя и ИХ предопределяет необходимость особого порядка загрузки мономеров. Исследование влияния этого фактора на ММ ПИД при прочих равных условиях их получения привели к следующим результатам, представленным в схематическом виде:
1)БФ— МП — ТЭА. — ИХ — 1р ([п] = 0,31);
2)БФ — МП — ИХ — ТЭА. — 1р ([п] = 0,28);
3)ИХ — ТЭА — БФ — МП — 1р ([п] = 0,20);
4)БФ— МП — ТЭА.— ИХ (в р-ре)— tр ([п] = 0,16);
5)БФ— МП — ИХ (в р-ре)— ТЭА.— tр ([п] = 0,14).
Найденный оптимальный режим синтеза (продолжительность 17-19 часов, температура 170-180 оС, концентрация мономеров 0,7-0,8 моль/л при избытке ИХ 0,0110,007 моль/л в среде МП в присутствии стехиометрического количества ТЭА, способ загрузки 1) позволил перейти к получению ПИД по приведенной выше общей схеме.
Характеристики полученных полимеров приведены в таблице 2 и 3. По способности образовывать высокомолекулярные полимеры ИХ-К и ИХ-А сложно дифференцировать, но различия внутри групп очевидны. В зависимости от строения радикала ИХ-А можно расположить в следующий ряд: 4,4-дифенилметан > 4,4-дифенилоксид > ж-фенилен > и-фенилен. Среди ИХ-К, также наблюдается зависимость в ряду 4,4-дифенилоксид > изофталат > терефталат. Электроноакцепторные группы, увеличивающие кислотность бис-фенола, уменьшают реакционную способность феноксидного иона [6]. Тогда вполне объяснима наблюдаемая зависимость БФ в способности образовывать высокомолекулярные продукты в ряду: бис-фенол-А > резорцин > бис-фенол-S > гидрохинон.
Структуры ПИД были идентифицированы элементным анализом и методами ИК и
13
ЯМР С-спектроскопией, причем значительных спектральных различий межу ПИД-А и ПИД-К не наблюдалось. Так в ИК-спектре полимеров присутствуют характеристические полосы поглощения азометиновой связи 1690-1660 см-1 и поглощение при 1220-1200 см-1 имидоэфирной связи (С-О), свидетельствующие об образовании имидатной функциональной связи. Химический сдвиг имидоэфирного атома углерода в спектре ЯМР 13С наблюдается при 8=153.7-155.2 м.д., а углеродные ядра бензо-групп резонируют в области 8=119.7-132.6 м.д.[1].
Все полимеры растворимы без стадии набухания в полярных амидных растворителях, нитробензоле, диоксане, ацетоне. Среди различных характеристик полимеров большое значение имеет термическая устойчивость, т. к. именно этот показатель определяет границы применения полимера. Температуры начала разложений
содержание:
[стр.Введение] [стр.1] [стр.2] [стр.3]