 |
 Как обустроить мансарду?  Как создать искусственный водоем?  Как наладить теплоизоляцию?  Как сделать стяжку пола?  Как выбрать теплый пол?  Зачем нужны фасадные системы?  Что может получиться из балкона? |
Главная страница » Энциклопедия строителя
содержание:
[стр.Введение] [стр.1] [стр.2]
страница - 1
имеют более сложный вид. Электропроводность сначала уменьшается, достигает минимального значения при определенном времени обработки, а затем возрастает. По аналогии с методом кондуктометрического титрования [6] этот минимум будем называть точкой эквивалентности. Можно предположить, что до точки эквивалентности в растворе происходят следующие реакции:
4FeSO4 + O3 + H2O = 4Fe(OH)SO4 + 1 O2,
Fe(OH)SO4 + 2H2O = Fe(OH)3^ + H2SO4. Образование труднорастворимого гидроксида железа приводит к уменьшению электропроводности раствора. После прохождения точки эквивалентности ее рост обусловлен, по-видимому, насыщением воды углекислым газом, поступающим в раствор вместе с озоновоздушной смесью. При растворении углекислого газа образуется угольная кислота по реакции:
CO2 + H2O ^ H2CO3 ^ H+ +HCO3- ^ 2H+ +CO32-. Появление в растворе высокоподвижных ионов водорода вызывает рост электропроводности.
Для проверки предположения о влиянии растворенного углекислого газа на рост а был проделан следующий опыт: через деионизованную воду в течение 2 часов продувался воздух, при этом электропроводность воды возрастала более чем на два порядка. На основе обработанной таким образом воды были изготовлены растворы FeSO4 различной концентрации. В дальнейшем эти растворы и обработанная воздухом вода подвергались озонированию. Из измеренной электропроводности озонированных растворов была вычтена электропроводность озонированной воды и построены зависимости разностной проводимости от времени пропускания озона Ao~(t). Они представлены на рис.2.
5
О
5
80
60 4
40
о
СО ГО
20 4
20 мг/л
10 мг/л
5 мг/л
0 2 4 68 10 12 14
время, мин
Рис.2. Зависимость Aa(t) предварительно подготовленной воды.
До точки эквивалентности Аа падает за счет связывания ионов железа в труднорастворимый гидроксид. После точки эквивалентности разностная электропроводность практически не меняется, т.к. все ионы железа уже связаны, а влияние растворенного углекислого газа устранено. Таким образом, изменение наклона зависимости a(t) до точки эквивалентности связано с изменением концентрации ионов трехвалентного железа в растворе. Для низких концентраций железа (0,5 + 1 мг/л) изменение электропроводности в ходе реакции с озоном оказывается незначительным и ее рост определяется растворением углекислого газа, поэтому точки эквивалентности не наблюдается (рис. 1, а, б).
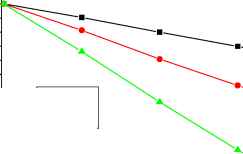
На рис.3 приведены зависимости относительной разностной проводимости растворов (Aa(t)/Aa(0)) для малых времен обработки озоном.
1,00 0,95 0,90 0,85 0,80 0,75 0,70
0,0
—■— 10 мг/л —•— 5 мг/л —*- 1 мг/л
0,2
0,40,6
время,мин
0,8
1,0
0,24-
га
о 0,20-
га х
g 0,16 о
£ 0,12
х
га
0,08
46 концентрация, мг/л
10
0
Л \-О О
н
СЕ О
в
О
р
I-
о о
н
to со
р
IS
о о г I-о
Рис.3. Зависимость Aa(t)/Aa(0) для малых
Рис.4. Концентрационная зависимость
Электронный журнал ИССЛЕДОВАНО В РОССИИ 1 5 79 http://zhurnal.ape.relarn.ru/articles/2005/150.pdf времен обработкитангенса угла наклона
Видно, что наклон прямых обратно пропорционален концентрации ионов железа. По величине тангенса угла наклона данных прямых можно судить о скорости протекания реакции окисления ионов двухвалентного железа в трехвалентное и образования труднорастворимого гидроксида. Концентрационная зависимость тангенсов углов наклона представлена на рис. 4. Она может быть применена для определения содержания железа в воде.
Для подтверждения того, что под действием озона происходит окисление двухвалентного железа, был проведен колориметрический анализ растворов роданидным методом. Известно, что ионы трехвалентного железа образуют с роданид- ионами ряд комплексов красного цвета, причем эта реакция достаточно чувствительна и ею можно определять концентрации железа до 0,05 мг/л [7].
Для определения содержания железа к 25 мл исследуемой пробы прибавляли 1 мл разбавленной HNO3 (1:1). После интенсивного взбалтывания добавляли 5 мл 10% -ного раствора роданистого калия. Интенсивность окраски полученного раствора сравнивали с интенсивностью окраски раствора с известным содержанием железа [8].
Было приготовлено несколько растворов FeSO4 с одинаковой концентрацией 5 мг/л. Первый раствор не подвергался действию озона. При колориметрировании данного раствора окрашивания не наблюдалось, т.е. концентрация трехвалентного железа в нем близка к нулю. Затем исследовались растворы, озонированные в течение разных промежутков времени. После пропускания озона в течение 15 секунд раствор имеет желтовато-розовое окрашивание, что соответствует концентрации ионов Fe3+ ~ 1,0 мг/л. После пропускания озона в течение 30 сек окраска раствора усиливается и становится желто-красной, соответствующей содержанию трехвалентного железа ~ 2,0 мг/л. При действии озона в течение 60 сек раствор имеет ярко красное окрашивание, которое наблюдается при концентрации Fe3+ ~ 5,0 мг/л. Дальнейшее увеличение времени воздействия озоновоздушной смесью не приводит к заметному изменению окраски раствора, из чего можно сделать вывод, что основное количество двухвалентного железа переходит в трехвалентное в течение первой минуты озонирования. Для концентрации железа 10 мг/л максимальное окрашивание раствора приходилось на время озонирования 90 сек. Полученные результаты хорошо согласуются с положением точек эквивалентности на зависимостях o~(t) (рис 1, в, г).
содержание:
[стр.Введение] [стр.1] [стр.2]