 |
 Как обустроить мансарду?  Как создать искусственный водоем?  Как наладить теплоизоляцию?  Как сделать стяжку пола?  Как выбрать теплый пол?  Зачем нужны фасадные системы?  Что может получиться из балкона? |
Главная страница » Энциклопедия строителя
содержание:
[стр.Введение] [стр.1] [стр.2]
страница - 1
.0
с; о
ci
1250 1000 750 500 250
200
CD О О
250
300
T, K
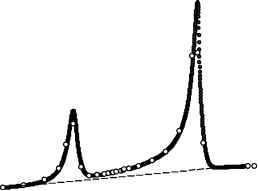
Рис. 1. Экспериментальные значения теплоемкости таллиевого натролита в области фазовых переходов, полученные методом ступенчатого (о) и непрерывного (•) нагрева.
Расчет энтальпии и энтропии обнаруженных фазовых переходов был выполнен относительно графически проведенной регулярной кривой теплоемкости (на рисунке 1 показана пунктиром). Так как переходы частично перекрываются, в качестве границы между ними при расчете AtrH мы приняли температуру относительного минимума теплоемкости при 258.0 К.
Энтальпия и энтропия каждого из переходов определялись дважды: по данным соответствующего сканирования и с помощью специально выполненного длинного калориметрического опыта, охватывающего весь температурный интервал перехода. Для определения энтальпии фазового перехода при 252 К калориметрический опыт был проведен в интервале 217 - 262 К. Значение AtrH1 = 2049 Дж/моль, получено как среднее между результатами определений энтальпии перехода по сканированию и в калориметрическом опыте. Полученные двумя указанными способами результаты согласуются с точностью = 0.3 %. Энтропия перехода была рассчитана как AtrH1 /Т1 и составила AtrS1 = 8.14 Дж/(К моль). Таким же образом для второго перехода при 294 К была определена энтальпия AtrH2 = 6280 Дж/моль и энтропия AtrS2 = 21.37 Дж/(К моль). Основная погрешность в определении энтальпии обоих переходов связана с неопределенностью проведения регулярной части и границы между переходами. По нашей оценке, она не должна быть больше 3 - 5 %.
Экспериментальная зависимость Ср(Т) была сглажена сплайн-функциями. В качестве исходных данных для сглаживания были взяты экспериментальные данные по Ср(Т) при температурах от 6 до 220 К и значения теплоемкости, соответствующие проведенной
температурах.
Т, К | C ° | S°(T) | Н°(Т)-Н°(0) | Ф°(Т)* |
5.88 | 2.028 | 0.4388 | 2.088 | 0.0836 |
10 | 11.20 | 3.562 | 27.99 | 0.7628 |
15 | 24.70 | 10.66 | 117.8 | 2.806 |
20 | 36.16 | 19.39 | 270.9 | 5.844 |
25 | 46.53 | 28.58 | 477.8 | 9.467 |
30 | 56.53 | 37.95 | 735.6 | 13.43 |
35 | 66.27 | 47.40 | 1043 | 17.61 |
40 | 75.73 | 56.87 | 1398 | 21.92 |
45 | 84.97 | 66.32 | 1800 | 26.33 |
50 | 94.00 | 75.75 | 2247 | 30.80 |
60 | 111.4 | 94.43 | 3275 | 39.85 |
70 | 128.0 | 112.9 | 4472 | 48.97 |
80 | 144.1 | 131.0 | 5834 | 58.10 |
90 | 159.6 | 148.9 | 7353 | 67.19 |
100 | 174.3 | 166.5 | 9022 | 76.24 |
120 | 202.2 | 200.7 | 12790 | 94.15 |
140 | 228.4 | 233.9 | 17100 | 111.8 |
160 | 253.5 | 266.0 | 21920 | 129.0 |
180 | 277.6 | 297.3 | 27230 | 146.0 |
200 | 300.8 | 327.8 | 33020 | 162.7 |
220 | 324.9 | 357.5 | 39270 | 179.0 |
240 | 352.1 | 387.0 | 46040 | 195.1 |
251.70 | 368.9 | 404.1 | 50250 | 204.5 |
251.70 | 368.9 | 412.2 | 52300 | 204.5 |
260 | 380.8 | 424.4 | 55410 | 211.3 |
280 | 409.6 | 453.7 | 63320 | 227.5 |
293.91 | 429.6 | 474.0 | 69150 | 238.7 |
293.91 | 429.6 | 495.4 | 75430 | 238.7 |
300 | 438.4 | 504.3 | 78080 | 244.0 |
313.16 | 457.5 | 523.5 | 83980 | 255.4 |
298.15 | 435.8 ± 1.8 | 501.6 ± 2.0 | 77270 ± 300 | 242.4 ± 1.9 |
*Ф°(Т)= S°(T) - [Н°(Т)-Н°(0)]/Т
графически между 220 и 310 К регулярной кривой. Изменения энтальпии и энтропии вблизи фазовых переходов отнесены к температурам переходов. Сглаженные значения теплоемкости, а также величины абсолютной энтропии, разности энтальпий и приведенного потенциала Гиббса при выбранных температурах представлены в таблице 2.
Таблица 2. Теплоёмкость, энтропия (Дж /(К-моль), изменение энтальпии (Дж/моль) и приведённый потенциал Гиббса (Дж /(К-моль)) таллиевого натролита при некоторых
Точность термодинамических величин при 298.15 К оценена с учетом разброса экспериментальных точек, результатов измерений стандартного вещества - бензойной кислоты и погрешностей, связанных с расчётами термодинамических параметров фазовых переходов. Кроме того, учитывалась точность введения поправки на теплоемкость газообразного гелия, находившегося в калориметрической ампуле, количество которого было существенно большим по сравнению с градуировочными измерениями пустого калориметра. При этом основную погрешность вносит, к сожалению, неопределенность химического анализа образца: ошибка в 0.01 в подстрочном индексе таллия в химической формулеобразцаприводиткпогрешностив
0.3 % в термодинамических функциях.
Обсуждение результатов
На рис. 2 представлены зависимости Ср(Т) для Tl-натролита и К-натролита [2] (только ступенчатые опыты) во всем интервале температур. Наибольшие различия в теплоёмкости наблюдаются при температурах ниже 80 К и в области фазовых переходов. У К-натролита вблизи 250 К имеется два пика на кривой Ср(Т), отстоящие друг от друга на 2 К (на рисунке не показаны), что может свидетельствовать о двух последовательно происходящих фазовых переходах. У Tl-натролита два фазовых перехода разнесены более, чем на 40 К, причем первый из них происходит при 251.7 К, т.е. практически при той же температуре, что и сдвоенный переходуК-натролита.
Рис. 2. Сравнение зависимостей Ср(Т) для таллиевого (о) и калиевого (•)

1200
0
100
200
300 T, K
натролитов.
В работе [1] отмечено влияние степени гидратации Tl-натролита на поведе-ние теплоемкости вблизи фазового перехода. При этом авторы имеют в виду только аномалию
содержание:
[стр.Введение] [стр.1] [стр.2]